Artigos
Quarto dos Fundos
Multimídia
André Fraga admite dificuldade para mobilizar politicamente a militância ambiental na Bahia
Entrevistas
"É um povo que tem a independência no DNA", diz Pedro Tourinho sobre tema do 2 de Julho em Salvador
anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou novas instruções e atualizou o sistema para que pacientes e profissionais de saúde consigam obter informações atualizadas sobre medicamentos similares intercambiáveis.
A nova ferramenta vai possibilitar e definir como medicamento similiar aquele que contém os mesmos princípios ativos, concentração, forma farma?eutica, via de administração, posologia e indicação terapêutica do medicamento de referência. Segundo publicação da Agência Brasil, esses remédios podem ser diferenciados apenas por características como tamanho e forma do produto, prazo de validade, embalagem, rotulagem, excipientes e veículos.
“Atualmente, a grande maioria dos medicamentos similares já tem comprovação de equivalência terapêutica com os medicamentos de referência, o que garante a substituição de forma segura”, explicou à agência de saúde.
A Anvisa publicava desde 2014 uma lista atualizada de medicamentos similares intercambiáveis. A estrutura, de acordo com o órgão, não era produtiva, já que a lista se torna ultrapassada sempre que um registro de medicamento similar é publicado, o que pode acontecer quase toda semana.
Agora, com as novas normas para se obter os medicamentos similares intercambiáveis, por meio de um sistema de consultas, a proposta torna com que as informações sejam atualizadas diariamente, possibilitando dados mais recentes do que a publicação de listas.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a venda de álcool etílico na concentração de 70% na forma líquida para o Rio Grande do Sul de forma. A medida foi estabelecida como emergencial e temporária devido à situação das chuvas e enchentes no estado.
A medida foi publicada no Diário Oficial da União (DOU) na última sexta-feira (10). A determinação estabelece que o produto seja comercializado até o dia 31 de agosto deste ano. Na prática, ela é autorizada por mais 90 dias após o fim do período para que os estabelecimentos terminem o estoque.
Em nota, a agência menciona que o líquido é uma “ferramenta eficaz na prevenção da proliferação de microrganismos prejudiciais à saúde” e que, durante a crise no estado gaúcho, “pessoas podem não ter acesso a métodos adequados de limpeza, higienização de objetos, antissepsia das mãos e outras ações fundamentais para evitar doenças relacionadas a situações de enchentes”.
A resolução é uma das medidas implementadas pela autarquia para diminuir os impactos do evento climático no Sul. As ações projetam, por exemplo, a suspensão de prazos administrativos e a flexibilização de receitas de remédios de uso controlado.
Outras ações estão relacionadas a permissão para a entrega de medicamentos experimentais a participantes de pesquisa clínica onde eles estiverem residindo ou abrigados e a simplificação do procedimento de doação internacional de alimentos, cosméticos, produtos de higiene e saneantes sujeitos à fiscalização sanitária.
A Agência Nacional de Vigilância Sanitária (Anvisa), publicou, nesta quarta-feira (24), a resolução que proíbe a fabricação, importação, comercialização, distribuição, armazenamento, transporte e a propaganda de dispositivos eletrônicos para fumar, os denominados cigarros eletrônicos ou “vapes”. A publicação chega após a Anvisa manter o veto do produto na última sexta-feira (19).
O texto estabelece os dispositivos eletrônicos para fumar como “produto fumígeno cuja geração de emissões é feita com auxílio de um sistema alimentado por eletricidade, bateria ou outra fonte não combustível, que mimetiza o ato de fumar”. Os objetos proíbidos que foram incluídos na categoria são produtos descartáveis ou reutilizáveis; produtos que utilizem matriz sólida, líquida ou outras, dependendo de sua construção e design; produtos compostos por unidade que aquece uma ou mais matrizes: líquida (com ou sem nicotina); sólida (usualmente composta por extrato ou folhas de tabaco – trituradas, migadas, moídas, cortadas ou inteiras, ou outras plantas); composta por substâncias sintéticas que reproduzam componentes do tabaco, de extratos de outras plantas; por óleos essenciais; por complexos vitamínicos, ou outras substâncias.
Entraram também na lista os produtos conhecidos como e-cigs, electronic nicotine delivery systems (ENDS), electronic non-nicotine delivery systems (ENNDS), e-pod, pen-drive, pod, vapes, produto de tabaco aquecido, heated tobacco product (HTP), heat not burn e vaporizadores, entre outros.
A publicação proíbe também o ingresso no país de produtos trazidos por pessoas de fora, por qualquer forma de importação, incluindo a modalidade de bagagem acompanhada ou bagagem de mão.
“O não cumprimento desta resolução constitui infração sanitária”, destacou a Anvisa no texto.
Em reunião nesta sexta-feira (19), a diretoria da Agência Nacional de Vigilância Sanitária (Anvisa) formou maioria para manter proibidos os cigarros eletrônicos no Brasil. A norma aprovada substitui a resolução estipulada em 2009, endurecendo as regras atuais.
A resolução aprovada pelo colegiado é mais dura que a norma vigente, pois, além de proibir a venda, propaganda e importação dos aparelhos, coíbe produção, armazenamento, distribuição e transporte dos Dispositivos Eletrônicos para Fumar (DEFs), vapes, pods, entre outros, no país.
A nova regra estabelece normas mais bem definidas sobre os aparelhos e estipula que os DEF’s são todo “produto fumígeno cuja geração de emissões é feita com auxílio de um sistema alimentado por eletricidade, bateria ou outra fonte não combustível, que mimetiza o ato de fumar”.
POSICIONAMENTO DA INDÚSTRIA
Em nota enviada ao Metrópoles, parceiro do Bahia Notícias, a empresa Philip Morris Brasil posicionou-se de forma contrária a decisão da Anvisa, ao afirmar que a decisão está em “descompasso com o crescimento descontrolado do mercado ilícito comprovadamente acessível a cerca de 4 milhões de brasileiros que utilizam diariamente um produto sem qualquer controle de qualidade”.
A Philip Morris Brasil ainda ressaltou que “dispositivos eletrônicos certificados, como os que utilizam a tecnologia de tabaco aquecido, já são vendidos em mais de 80 países, como toda a União Europeia, Japão, Coréia do Sul, Canadá, Nova Zelândia. Resultados divulgados por diversas agências de saúde ao redor do mundo comprovam que eles podem oferecer menos risco que o cigarro convencional”.
Já a BAT Brasil, em nota enviada ao Metrópoles, disse que não concorda com a decisão da Anvisa. “O resultado da Consulta Pública, encerrada em fevereiro deste ano, mostrou que a maioria dos participantes não concorda com a atual norma de proibição”, destacou.
O grupo também destaca que o “parecer vai na contramão da percepção da sociedade e das diversas evidências científicas internacionais que comprovam que os produtos alternativos de nicotina são fundamentais para a redução de danos à saúde de adultos fumantes”, acrescenta.
Os diretores da Agência Nacional de Vigilância Sanitária (Anvisa) vão discutir na próxima sexta-feira (19) a regulação dos cigarros eletrônicos no Brasil. O encontro tem o intuito de discutir a proposta de manutenção da proibição de comercialização, fabricação e importação, além da propaganda desses produtos através de qualquer meio.
Os dispositivos eletrônicos para fumar (DEFs), conhecidos como cigarros eletrônicos, são proibidos no Brasil desde 2009. Vape, pod e os acessórios que se encaixam nessa categoria também são proibidos. No entanto, no ano passado a Anvisa aprovou a consulta pública sobre a produção e regulação dos produtos eletrônicos.
A resposta de especialistas e da população serviria para ajudar na elaboração de um possível termo para regular os objetos ao invés de proibi-los. Em 2022, a agência teria aprovado por unanimidade um relatório que apresentava a manutenção da proibição e indicava a adoção de iniciativas para aprimorar a fiscalização.
Anteriormente, o Ministério da Saúde se posicionou contra flexibilizar a proibição, apontando que o uso desses dispositivos representa um risco à saúde da população brasileira.
(Matéria atualizada as 11h48)
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou que o álcool líquido 70% não seja mais vendido e comercializado em supermercados e outros estabelecimentos no Brasil. A medida entra em vigor, a partir do próximo dia 30 de abril.
A determinação da Anvisa não afetará a venda do álcool 70% em gel, será somente proibido a venda do produto líquido. A comercialização do produto já era proibida há mais de 20 anos, por conta da sua alta inflamabilidade. No entanto, a venda do produto foi flexibilizada pela agência por conta da pandemia da Covid-19.
A Anvisa reforçou ainda por meio de nota à imprensa, que além do álcool líquido 70%, os consumidores ainda vão continuar tendo outras opções para limpeza disponíveis no mercado, como produtos desinfetantes que não contêm álcool, mas ainda são eficazes contra germes, incluindo o vírus da Covid-19.
A consulta pública da Agência Nacional de Vigilância Sanitária (Anvisa) sobre a manutenção dos cigarros eletrônicos no Brasil termina nesta sexta-feira (9). A participação social deve ser efetuada através de um formulário eletrônico específico, disponibilizado no portal da Anvisa. Para participar é necessário preencher os campos de identificação com os dados e enviar as contribuições.
A consulta foi iniciada no mês de dezembro, quando a Anvisa deu 60 dias para a sociedade opinar sobre o texto que projeta a manutenção da proibição dos dispositivos eletrônicos para fumar no país.
Inicialmente, a proposta proíbe a fabricação, importação, comercialização, distribuição, armazenamento, transporte, publicidade e divulgação destes produtos ao público, que é consumidor ou não. A participação social de caráter consultivo, tem o intuito de ajudar a Anvisa a tomar decisões relativas à formulação e definição de políticas públicas em torno dos dispositivos eletrônicos para fumar (DEFs).
Após receber as contribuições, a Anvisa vai analisar e divulgar as decisões em um relatório da consulta pública no próprio portal. O processo pode durar alguns meses.O cigarro eletrônico é proibido no Brasil, desde 2009. Não é permitido importar, comercializar e fazer propaganda de quaisquer tipos de dispositivos eletrônicos para fumar, por determinação da Anvisa, na Resolução da Diretoria Colegiada (RDC) 46/2009.
Na ocasião, a agência reguladora justificou a decisão baseada no princípio da precaução, devido à inexistência de dados científicos que comprovem as alegações atribuídas a esses produtos.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta sexta-feira (12) edital do concurso público para preenchimento de 50 vagas de especialistas em regulação e vigilância sanitária.
As inscrições terão início às 10h do dia 22 de janeiro e vão até as 16h (horário de Brasília) do dia 16 de fevereiro de 2024. O valor da taxa de inscrição é de R$ 160. As provas serão aplicadas no dia 21 de abril, no período vespertino, em Brasília.
O salário inicial é de R$ 16.413,35 para jornada de 40 horas semanais.
De acordo com o edital, o concurso terá duas etapas. A primeira é composta pelas provas objetiva, discursiva – eliminatórias e classificatórias – e avaliação de títulos, com caráter classificatório. Na segunda etapa, será realizado curso de formação, com eliminação e classificação.
A empresa contratada para executar o concurso é o Centro Brasileiro de Pesquisa em Avaliação e Seleção e de Promoção de Eventos (Cebraspe).
O resultado final das provas objetivas e provisório da discursiva serão divulgados no dia 21 de maio de 2024. Os aprovados irão integrar o quadro de pessoal da agência reguladora.
Quem pode participar
Veja abaixo a distribuição das vagas e formação em nível superior exigida:
Especialista em Regulação e Vigilância Sanitária - Área 1
Vagas: 3 (duas para ampla concorrência e uma para candidatos negros)
Diploma em engenharia química, química, bioquímica, engenharia de materiais, engenharia mecânica ou engenharia agronômica, reconhecido pelo Ministério da Educação (MEC).
Especialista em Regulação e Vigilância Sanitária - Área 2
Vagas: 39 (29 para ampla concorrência, duas para pessoas com deficiência e oito para negros)
Diploma em farmácia, reconhecido pelo MEC.
Especialista em Regulação e Vigilância Sanitária - Área 3
Vagas: 5 (três para ampla concorrência, um para pessoa com deficiência e uma para negro)
Diploma em biologia, enfermagem, odontologia, biomedicina, fisioterapia ou veterinária, reconhecido pelo MEC.
Especialista em Regulação e Vigilância Sanitária - Área 4
Vagas: 3 (duas para ampla concorrência e uma para negro)
Diploma em análise de sistemas, ciência da computação, processamento de dados, sistemas de informação, informática, engenharia da computação, engenharia de sistemas ou engenharia de redes, reconhecido pelo MEC.
A Agência Nacional de Vigilância Sanitária (Anvisa) pediu a proibição e recolhimento de todos os coletores menstruais POP, da empresa Fleurity. A decisão foi publicada no Diário Oficial da União, da última quarta-feira (3). A agência alegou que o produto estava sendo comercializado sem regularização, ou seja, não estava registrado no Ministério da Saúde. Desde a última quinta-feira (4), o coletor já não estava mais disponível para compra em grande parte das vendas, segundo a Folha de São Paulo.
O objeto, vendido a um preço médio de R$ 30, era uma versão mais popular da linha de produtos da empresa, tanto que na embalagem, o produto era descrito como “coletor mais econômico do Brasil”, sem indicar o nome Fleurity. A marca tem coletores de preço mínimo de de R$ 49,90. Quase R& 20 reais mais caro que a versão popular.
A empresa ainda não se pronunciou sobre a decisão da Anvisa.
A Agência Nacional de Vigilância Sanitária (Anvisa) cancelou, nesta quarta-feira (20), mais de 500 registros de produtos para alisar ou ondular os cabelos. A medida é baseada em um artigo que determina o cancelamento do registro para empresas que não fizeram as adequações de rotulagem previstas na resolução.
O cancelamento estava previsto no art. 14-A da RDC 409, de 27 de julho de 2020. A iniciativa estabelece o cancelamento do registro para empresas que não fizessem adequações de rotulagem previstas na resolução.
Com a norma, a fabricação ou comercialização dos produtos que constam na lista configura infração sanitária, sujeitando o infrator às penalidades previstas na Lei 6.437/1977.
A lista completa com todos os produtos que foram suspensos podem ser conferidos no portal do governo.
A diretoria colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) vai discutir nesta sexta-feira (1º) se colocará a regulamentação de cigarros eletrônicos no Brasil em consulta pública.
O produto tem a fabricação proibida pela Anvisa desde 2009, por conta de uma resolução que também não permite a comercialização, a importação e a propaganda de dispositivos eletrônicos para fumar.
A pauta foi colocada em publicação durante reunião da entidade ocorrida, na última quarta-feira (22). A agência afirmou que o tema será debatido após receber diversos pedidos de manifestação oral e de acesso às dependências da entidade por representantes do setor regulado, de entidades civis e pela população em geral que deseja acompanhar a deliberação.
Manifestações públicas em frente à sede da Anvisa, em Brasília, serão realizadas por entidades que têm interesse na temática. O encontro vai contar com a presença de representantes do segmento.
Já o debate será transmitido por meio do canal oficial da Anvisa no Youtube. Pessoas interessadas e a favor da regulamentação podem enviar manifestações orais para conhecimentos dos diretores. Os pedidos serão publicados no site da organização e reproduzidos durante o encontro.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a composição de vacinas contra a influenza que serão utilizadas em 2024 no Brasil. O órgão destacou em nota enviada à imprensa que a alteração na composição de cepas ou tipos de vírus da vacina contra a influenza teria uma grande importância para a eficácia da dose, já que o vírus sofre mutações e adaptações.
“A Organização Mundial da Saúde (OMS) analisa regularmente todos os subtopos do vírus da gripe que circulam com maior frequência para melhorar a eficácia da imunização”, diz o comunicado da Anvisa.
As vacinas trivalentes produzidas a partir de ovos de galinha devem utilizar as seguintes cepas para 2024: Influenza A/Victoria/4897/2022 (H1N1)pdm09; Influenza A/Thailand/8/2022 (H3N2); Influenza B/Austria/1359417/2021 (B/linhagem Victoria).
Já as vacinas que não utilizam ovos na composição, devem utilizar a cepa do vírus A (H1N1) deve ser um vírus similar ao vírus influenza A/Wisconsin/67/2022 (H1N1)pdm09. A cepa A (H3N2) deve ser um vírus similar ao vírus influenza A/Massachusetts/18/2022 (H3N2), juntamente com a cepa B.
Segundo publicação da Agência Brasil, as vacinas quadrivalentes devem apresentar, além dos três tipos de cepas obrigatórios, um vírus similar ao vírus Influenza B/Phuket/3073/2013 (B/linhagem Yamagata).
Em comunicado divulgado na última sexta-feira (29), a Agência Nacional de Vigilância Sanitária (Anvisa) determinou a suspensão de comercialização, distribuição e uso de lotes da Sidra Cereser sabor maçã (garrafa de vidro verde contendo 660ml). A empresa produtora da bebida também iniciou o recolhimento voluntário dos produtos afetados.
De acordo com a Resolução-RE nº 3.718/2023 baixada pelo órgão, o recolhimento é devido à possibilidade da presença de pequenos fragmentos de vidro na bebida. A ingestão acidental dos fragmentos de vidro representa risco de danos à saúde, como cortes na boca ou outras partes do sistema digestivo se ingerido.
"Aproximadamente 0,2% dos lotes afetados podem ter sido impactados por alteração dos vasilhames durante o processo de envase, o que levou à transferência de pequenos fragmentos de vidro para o interior das garrafas", diz a nota da agência.
Serão recolhidos 28 lotes, fabricados em 22/07/2023, 16/08/2023 a 02/09/2023, que totalizam 2.237.952 unidades do produto ou 186.496 caixas.
CONFIRA O NÚMERO DOS LOTES ENVOLVIDOS NO CASO:
L22 203 742 07; L22 203 743 07; L22 228 751 07; L22 228 752 07; L22 229 752 07; L22 229 753 07; L22 230 753 07; L22 230 754 07; L22 231 754 07; L22 231 755 07; L22 235 756 07; L22 236 756 07; L22 236 757 07; L22 237 757 07; L22 237 758 07; L22 237 759 07; L22 238 759 07; L22 238 760 07; L22 241 760 07; L22 241 761 07; L22 242 761 07; L22 242 762 07; L22 243 762 07; L22 243 763 07; L22 244 763 07; L22 244 764 07; L22 245 764 07; L22 245 765 07.
Caso você possua o lote informado, entre em contato com a empresa pelo telefone 0800 702 2517 ou pelo e-mail [email protected] para orientações sobre o procedimento de recolhimento ou substituição.
Os lotes podem ser verificados na parte superior da embalagem, impressos na cor preta sobre o lacre dourado.
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a fabricação, a comercialização, a distribuição, a propaganda e o uso do suplemento alimentar Soninho Perfeito Melatonina Kids, fabricado pela empresa Mr Oemed Indústria Farmaceutica Ltda. O órgão regulador determinou ainda o recolhimento do produto do mercado.
Em nota, a Anvisa informou que a melatonina - hormônio produzido pelo organismo - não é autorizada para uso em suplementos alimentares destinados a crianças e adolescentes e que não há segurança de uso comprovada perante a agência para essas faixas etárias.
“A melatonina também não possui autorização para gestantes e mulheres que amamentam (lactantes) e só é aprovada em suplementos destinados para adultos acima de 19 anos, na concentração de 0,21 miligramas por dia e sem alegações de uso”, alerta.
De acordo com a agência, também foi verificada a divulgação irregular, na internet, do produto, com alegações terapêuticas relacionadas a sono, ansiedade, compulsão alimentar, irritabilidade noturna, inflamação, suplementação para transtorno do espectro autista e câncer.
“Nenhuma dessas alegações é aprovada pela Anvisa, tratando-se, portanto, de propaganda irregular”, diz a Anvisa.
No comunicado, o órgão regulador alerta que não há aprovação de suplementos alimentares à base de melatonina para sono, humor e concentração. “Qualquer propaganda ou rótulo que traga esse tipo de alegação está irregular de acordo com a legislação sanitária brasileira”.
O presidente Lula (PT) sancionou a lei que autoriza a terapia com ozônio no Brasil. O texto da sanção foi publicado na edição do Diário Oficial da União desta segunda-feira (7).
O PL nº 1.438/2022 permite que a aplicação da técnica seja utilizada como “caráter complementar” às demais alternativas. A decisão possibilita que o procedimento seja realizado somente por um profissional de saúde com nível superior, inscrito no conselho de fiscalização. O equipamento utilizado pelo profissional deve estar devidamente regularizado pela Agência Nacional de Vigilância Sanitária (Anvisa).
A lei determina que a técnica seja utilizada ainda para complementar o tratamento de doenças quando os profissionais de saúde considerarem pertinente. Antigamente a terapia com ozônio já era utilizada em alguns tratamentos estéticos e odontológicos.
Compartilhe essa notícia pelo WhatsApp!
A ozonioterapia é feita através da aplicação de oxigênio e ozônio diretamente na pele ou sangue do paciente, a partir da aplicação local, na boca, venosa, retal ou por injeção subcutânea, a depender do intuito de cada caso. O procedimento tem o objetivo de conter infecções ou aumentar a oxigenação do tecido.
Usuários da terapia apontam que ela auxilia no combate a bactérias e fungos sem sistemas de proteção contra a atividade oxidativa do ozônio, além de melhorar a oxigenação do sangue, a circulação e permitir o crescimento de ações anti-inflamatórias do corpo. Ela ainda melhora a imunidade, diminui a dor, o inchaço e combate microrganismos.
A autorização pelo presidente Lula veio após a ozonioterapia ter sido alvo de polêmicas durante a pandemia de Covid-19, quando o prefeito de Itajaí, Volnei Morastoni (MDB), recomendou o uso da terapia contra o coronavírus.
Neste ano, o tema também passou por polêmicas quando a Academia Nacional de Medicina (ANM) se mostrou contra a prática e pediu veto ao Projeto de Lei através de uma carta enviada ao presidente Lula, no mês passado. O pronunciamento da entidade aconteceu depois que o Senado aprovou a lei que autoriza a o procedimento no Brasil.
A ANM explicou que não tinha conhecimento e acesso aos trabalhos científicos que comprovassem a eficácia da terapia com ozônio em nenhum caso. A organização alertou também que a prática pode trazer riscos à saúde.
A Agência Nacional de Vigilância Sanitária (Anvisa) atualizou a norma que permite a realização de exames de 47 tipos de exames de análise clínica (EAC), em farmácias e consultórios. Com a nova regra, os laboratórios terão um prazo de 180 dias para adequação.
Os exames de análises clínicas (EAC) são todos aqueles que tem como base fluidos do organismo, como sangue, urina, fezes e secreções. Antes da nova regra, a Anvisa liberou a somente a realização de testes de Covid-19 e de glicemia.
A Anvisa explicou que os resultados dos exames e testes feitos em farmácias ou consultórios não podem ser substituídos ou utilizados sozinhos para tomar decisões médicas. Eles devem servir somente como uma primeira avaliação.
"A resolução aprovada substitui a RDC (Resolução da Diretoria Colegiada) 302/2005, uma vez que a evolução do setor de diagnósticos, assim como dos produtos e instrumentos para diagnóstico, é evidente, e a defasagem da norma frente à realidade tecnológica já era apontada desde a abertura do processo regulatório, em 2017", diz o texto da resolução.
Com a nova atualização da norma, as farmácias estão aptas a fazer exames de análises clínicas a partir de material biológico primário, porém todas as etapas precisam ser feitas depois da coleta no próprio estabelecimento e não deve necessitar instrumentos para leitura, interpretação e visualização do resultado.
Segue proibido guardar, transportar, receber ou enviar material biológico para outros serviços, bem como realizar punção venosa e arterial.
Segundo a agência, apenas profissionais treinados podem fazer a coleta.
A nova orientação apontou que o resultado de um teste rápido precisa da interpretação de profissionais de saúde.
CONFIRA LISTA DOS EXAMES QUE PODEM SER FEITOS:
Beta-hCG
Dengue Anticorpos IgG IgM
Dengue Antígeno NS1
Hemoglobina Glicada A1c
Teste rápido PSA
Teste rápido Covid-19 Antígeno
Avaliação de controle da asma
Check-up pós Covid anticorpos Anti-Spike
Teste rápido Ácido Úrico
Teste rápido de Chikungunya
Colesterol Total
Exame de Glicemia
Glicemia e Pressão Arterial
Teste rápido de Hepatite C
Teste rápido de HIV
Exame de Hormônio Luteinizante (LH)
Teste rápido de Lactato
Teste rápido de Malária
Teste rápido de Sífilis
Toxoplasmose
Teste rápido de Troponina Cardíaca
VSR (Vírus Sincicial Respiratório)
Teste rápido de Ferritina
Teste rápido de Mioglobina
Teste rápido de Proteína C Reativa
Teste rápido de Rubéola
Teste rápido Streptococcus Grupo A Molecular
Teste rápido Streptococcus Grupo A
Teste rápido Vitamina D
Exame VSR (Vírus Sincicial Respiratório) molecular
Zika Vírus Anticorpos
Exames do Coração Check-up completo
Medição da pressão arterial
Teste de Glicemia e Perfil Lipídico
Teste de Imunidade Covid-19 Anticorpos Anti-Spike
Teste de Intolerância Alimentar
Teste rápido Adenovírus
Teste rápido Covid-19 Anticorpos
Teste rápido Covid-19 Antígeno + Anticorpos
Teste rápido Covid-19 Molecular
Teste rápido de Alergia Alimentar
Teste rápido de Dímero-D
Teste rápido Febre Amarela
Teste rápido Helicobacter Pylori
Teste rápido Influenza Molecular
Teste rápido Tipo Sanguíne
Dados da Agência Nacional de Vigilância Sanitária (Anvisa) apontam que a importação de produtos à base de cannabis aumentou 93% no Brasil nos últimos 12 meses.
Segundo o G1, a importação desses produtos avança ao mesmo tempo em que há uma tendência de redescoberta de princípios ativos da planta cannabis (popularmente conhecida como maconha) para tratamento de sintomas de condições que vão desde a epilepsia e o Parkinson até a ansiedade e a depressão.
A Anvisa autoriza, desde 2015, a importação de produtos derivados da cannabis. As formas de administração terapêutica mais comum são os óleos, pomadas, extratos e medicamentos. O uso recreativo da planta é ilegal no Brasil.
A Agência Nacional de Vigilância Sanitária (Anvisa), determinou novas regras para a rotulagem de produtos integrais, como pães, torradas e biscoitos.
As regras que entraram em vigor desde o mês de abril, foram criadas para determinar o que seria um alimento integral e suas definições. Para que o termo esteja escrito no rótulo, ele deve ter pelo menos 30% de ingredientes integrais, e a porcentagem precisa ser destacada na embalagem.
A nutróloga, Hilloa Rodrigues, explicou que a resolução, não se aplica às farinhas integrais e aos produtos feitos exclusivamente por cereais integrais, como o arroz integral. conforme explica a nutróloga, Dra. Hilloa Rodrigues, não se aplica às farinhas integrais e aos produtos feitos exclusivamente por cereais integrais, como o arroz integral.
“No geral, alimentos integrais são mais indicados porque têm lenta absorção no organismo, além de mais fibras. Por isso, um pão, um grão, qualquer alimento integral vão ter uma quantidade maior de fibras, que ajudam na glicemia, a não ter picos de açúcar no sangue”, disse a especialista.
De acordo com a nutróloga, as novas regras estipuladas pela Anvisa valem apenas para os alimentos que contêm cereais, como trigo e milho; pseudocereais, que são aqueles que não pertencem à família das gramíneas, mas têm sementes parecidas com os grãos dos cereais, como a quinoa e o trigo sarraceno.
“É importante salientar que antes de definir se um produto pode ser considerado integral, é necessário verificar seus ingredientes. Por conta disso, foi que a Anvisa começou a resolução separando o que são ingredientes integrais e refinados”, observou.
Conforme a especialista, os cereais integrais são aqueles que não passam pelo processo de refinamento, por isso conservam elementos externos como a casca, e mantêm a maior parte das fibras, vitaminas e minerais.
REGRAS
Segundo as novas regras da Anvisa, só serão classificados como integrais os produtos que tiverem, no mínimo, 30% de ingredientes integrais. Além disso, conforme a resolução, é necessário que, na soma total de ingredientes do alimento, a quantidade de integrais seja sempre maior que a de refinados.
Para a nutróloga, a resolução também determina que os produtos que trouxerem a palavra “integral” na embalagem devam informar a porcentagem total de ingredientes integrais presentes no alimento, com caracteres do mesmo tipo, tamanho e cor.
“Já no caso dos produtos líquidos, a palavra ‘integral’ deve ser substituída pela expressão ‘com cereais integrais’. Além disso, no caso dos alimentos concentrados ou em pó que precisam de reconstituição, essa porcentagem deve ser calculada considerando o produto pronto para o consumo”, explica.
De acordo com a Anvisa, os rótulos de alimentos que não atendam aos requisitos não podem conter vocábulos, sinais, denominações, símbolos, emblemas, ilustrações ou representações gráficas que indiquem que o produto é classificado como integral.
A resolução foi publicada no dia 1º de setembro de 2022, mas a Anvisa estabeleceu um prazo para que as marcas se adequassem às novas regras. Dessa forma, até 22 de abril deste ano, os produtos ainda podiam ser fabricados sem cumprir os novos requisitos e podem ser comercializados até o fim de seus prazos de validade. “Já no caso das massas, como espaguete ou penne, produzidas a partir de farinha, o prazo termina somente em 2024”, observa.
Por conta desses prazos, a especialista ainda explicou que o consumidor ainda pode encontrar as duas formas de rotulagem nos mercados.
MULTA
A especialista destaca que o descumprimento da resolução da Anvisa resulta em infração sanitária. “Dessa forma, as marcas que não se adequarem às novas regras podem receber penalidades como advertência, multa, interdição de produtos e até cancelamento de alvará”, conclui.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, em 19 de junho, a comercialização no Brasil de um novo medicamento contra o colesterol. Uma alternativa à tradicional estatina, a inclisirana é aplicada por meio de uma injeção, apenas duas vezes por ano.
O medicamento age contra o colesterol ruim (LDL), cujo acúmulo é um dos principais fatores de risco para infartos e derrames. A inclisirana bloqueia uma proteína (PCSK9) que danifica os receptores de LDL – são eles que captam o colesterol do sangue o levam para eliminação no fígado. Sem esse processo, a gordura fica circulando no corpo e se acumula nas artérias.
O novo remédio mostra que, com duas aplicações por ano, os níveis de LDL no sangue diminuem, em média, 52%. O medicamento usado hoje como referência pelo Ministério da Saúde, a estatina, reduz apenas 26% do colesterol. A inclisirana também causa menos efeitos colaterais ao paciente. Os dois medicamentos podem ser usados juntos.
Um dos maiores problemas do tratamento tradicional, em forma de pílulas que devem ser tomadas diariamente, é a falta de adesão. Como o colesterol alto não é uma doença com sintomas claros, muitos pacientes abandonam o tratamento depois de alguns meses. Aplicado apenas duas vezes no ano e no hospital, o novo medicamento pode oferecer uma solução para o problema.
A inclisirana já está sendo comercializada desde 2020 na União Europeia e desde 2021 nos Estados Unidos. Com a aprovação da Anvisa, o medicamento deve estar disponível em cerca de 90 dias, mas ainda não há estimativa sobre quando e se será incorporado pelo Sistema Único de Saúde (SUS). As informações são do portal Metrópoles.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou, nesta segunda-feira (19), uma nova resolução relacionada às pomadas para modelar, trançar ou fixar cabelos. A medida determina a interdição cautelar de todos os produtos desse tipo.
Segundo o órgão, a medida cautelar anterior perdeu sua vigência no dia 18 de junho, mas as causas dos eventos adversos graves relacionados ao uso dos produtos que ocorreram no Brasil, incluindo intoxicação ocular, permanecem sob investigação. Isso porque ainda estão sendo aguardados resultados de análises laboratoriais.
Além disso, nesse período de interdição, foi verificada a redução de casos de notificações de eventos adversos gerais relacionados a esses produtos. Destaca-se também que a Agência não recebeu relato de evento adverso grave relacionado a nenhum dos produtos da lista dos que estão autorizados.
A Anvisa disse ainda que entende que a ação de retirar do mercado grande parte dos produtos suspeitos foi efetiva para reduzir o risco à saúde. Diante disso, a agência decidiu publicar uma nova interdição cautelar para as pomadas capilares, mas manteve a lista de produtos autorizados.?
A resolução prevê a autorização de algumas destas pomadas, mas apenas as que possuem em sua composição concentração menor que 20% do ingrediente Ceteareth-20, que não tiveram relatos de eventos adversos graves, os produtos cujos processos de regularização não tenham sido cancelados e os que as empresas tenham apresentado termo de responsabilidade sobre a qualidade e a segurança do produto. A listagem foi divulgada no site da Anvisa.
A Agência Nacional de Vigilância Sanitária (Anvisa) solicitou ao Ministério da Gestão e da Inovação em Serviços Públicos (MGI) autorização para realizar concurso público para o preenchimento de 129 vagas que estão atualmente desocupadas.
Segundo a o órgão federal, sua gestão tem tentado a ampliação legal do número de vagas no quadro efetivo, como forma de recomposição da força de trabalho perdida com a aposentadoria dos servidores do quadro específico (servidores redistribuídos de outros órgãos, quando a Agência foi criada).
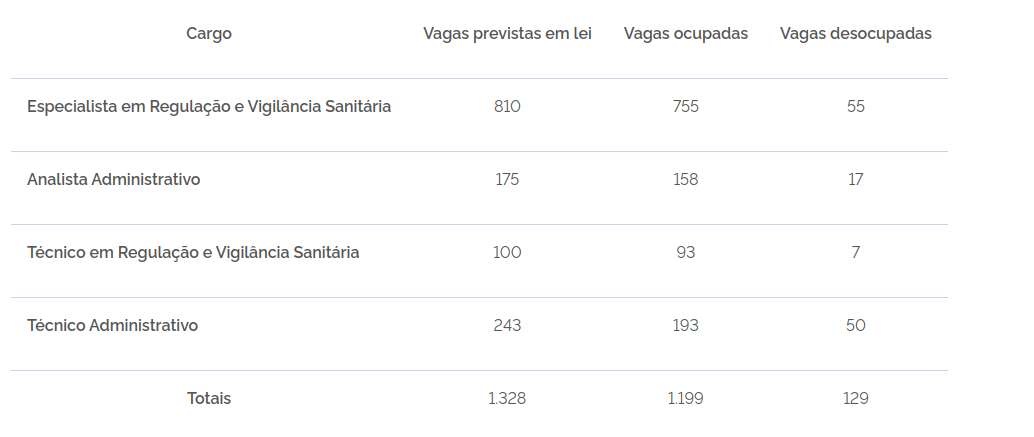
Foto: Reprodução / Anvisa
Os salários iniciais previstos, salientou o comunicado da Anvisa que divulgou a intenção de realizar o certame, podem ser consultados na tabela de remuneração dos servidores públicos federais, disponibilizada pelo Ministério da Gestão e Inovação.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro de medicamento Cabotegravir, injetável utilizado contra o vírus da imunodeficiência humana (HIV). O remédio é uma profilaxia pré-exposição (PrEP), ou seja, é utilizado para prevenir infecções.
A autorização foi publicada no Diário Oficial da União (DOU) na última segunda-feira (5). O medicamento será comercializado pela farmacêutica britânica GSK, que apresentou o pedido, mas ainda não há previsão para chegar ao mercado.
O Cabotegravir será comercializado sob o nome Apretude. Para que seja disponibilizado no Sistema Único de Saúde (SUS), é necessário que o remédio seja aprovado pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec), órgão colegiado do Ministério da Saúde.
O medicamento já foi aprovado em 2021 pela Food and Drug Administration (FDA), agência reguladora dos Estados Unidos. No ano passado, o Cabotegravir também foi recomendado pela Organização Mundial da Saúde (OMS).
Atualmente, a PrEP está disponível no SUS de forma oral, com comprimidos de uso diário. A nova injeção é vista como mais efetiva na prevenção, uma vez que requer duas aplicações no início do tratamento e reforço depois de dois meses. As informações são do portal Metrópoles.
A Agência Nacional de Vigilância Sanitária (Anvisa) revogou as duas portarias editadas durante a pandemia com medidas sanitárias para o ingresso de estrangeiros no país e agora os brasileiros ou estrangeiros que entram no Brasil não precisam mais apresentar comprovante de vacinação ou teste negativo de Covid-19.
Segundo a Anvisa, o fim das exigências foi motivado pela decisão da Organização Mundial de Saúde (OMS) de decretar o fim do estado de Emergência de Saúde Pública de Importância Internacional, que vigorava desde março de 2020.
De acordo com a Agência Brasil, o órgão regulatório repassou as orientações às companhias aéreas, postos de fronteira e operadores de portos e aeroportos em instrução técnica publicada em 23 de maio.
“Esse cenário [fim do estado internacional de emergência] possibilitou a determinação de que a Covid-19 é agora um problema de saúde estabelecido e contínuo (...) Desta forma, o Brasil deixa de exigir de viajantes de procedência internacional a comprovação vacinação contra a covid-19 ou apresentação de resultado negativo de teste, bem como da implementação pelos administradores de terminais de passageiros e operadores de meios de transporte de medidas de prevenção e mitigação [redução] da doença”, informou a nota técnica.
Apesar de revogar as exigências de testes ou de certificados de vacinação, a Anvisa informou, na nota técnica, que manteve as recomendações para medidas não farmacológicas de prevenção (como uso de máscaras), e as normas de notificação e de respostas a casos suspeitos e confirmados.
Os pontos de entrada no Brasil, devem continuar a ter planos de contingências atualizados para enfrentamento de futuras emergências sanitárias internacionais. Também deverão ser mantidas as medidas para garantir a vigilância e o atendimento dos casos suspeitos e confirmados de Covid.
A Anvisa também manteve a obrigação de administradores de terminais de passageiros e de meios de transporte comunicarem à agência reguladora eventos de saúde pública durante viagens. O isolamento de passageiros com sintomas compatíveis com Covid-19 ou com contaminação confirmada está mantido.
A Agência Nacional de Vigilância Sanitária (Anvisa) concedeu registro para produção nacional da vacina meningocócica ACWY conjugada, que protege contra quatro tipos de meningite.
O imunizante poderá ser produzido pela Fundação Oswaldo Cruz (Fiocruz) e pela Fundação Ezequiel Dias (Funed), em parceria com a farmacêutica GlaxoSmithKline (GSK), detentora da tecnologia.
O presidente da Fiocruz, Mario Moreira, destacou que o registro é mais um passo na busca pela autossuficiência nacional, por meio da redução da dependência de insumos internacionais e da incorporação de tecnologias estratégicas para o país. O acordo prevê a transferência de tecnologia, rotulagem e embalagem dos imunizantes pela Fiocruz e Funed e produção do ingrediente farmacêutico ativo (IFA), por meio do Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos), ligado à Fiocruz.
O Programa Nacional de Imunizações (PNI) recomenda o esquema de duas doses da vacina meningocócica C conjugada aos três e cinco meses de idade, e um reforço administrado aos 12 meses.
A vacina meningocócica ACWY conjugada é recomendada para adolescentes na faixa etária de 11 e 12 anos de idade em dose única. Recentemente, o Ministério da Saúde ampliou a indicação para adolescentes de 13 e 14 anos de idade, visando reduzir o número de portadores da bactéria em nasofaringe.
Em todo o mundo, estima-se que ocorram mais de um milhão de casos de meningites bacterianas a cada ano. Caso não haja tratamento, a taxa de mortalidade pode chegar a até 70%. Entre os anos de 2009 e 2021, foram confirmados no Brasil 219.342 casos de meningite bacteriana causada pelo meningococo.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou uma norma que permite a realização de exames de análise clínica em farmácias e consultórios. Os exames devem ser realizados nesses espaços somente em caráter de triagem e não substituem o diagnóstico laboratorial convencional.
A resolução entra em vigor em 1º de agosto e define uma nova categorização de serviços de saúde que realizam atividades relacionadas a exames de análise clínica: serviço tipo I (farmácias e consultórios isolados); serviço tipo II (postos de coleta); e serviço tipo III (laboratórios clínicos, laboratórios de apoio e laboratórios de anatomia patológica).
Os serviços tipo I e II são habilitados a realizar coletas e exames de análises clínicas em caráter de triagem a partir de material biológico primário (tecido ou ?uido constituinte do organismo humano ou isolado a partir destes que não sofreu alterações no seu estado natural ou que não foi submetido a atividades que visam a preparação para a análise), desde que todas as etapas do exame sejam realizadas após a coleta no próprio estabelecimento. As informações são da Agência Brasil.
"Assim, a norma aprovada possibilita a realização de testes de triagem nos serviços tipo I e tipo II, os quais não ultrapassam o diagnóstico laboratorial convencional e nem o substituem, pois a sua atuação é complementar, com finalidades distintas no atendimento à população", destacou a Anvisa.
"Os resultados dos testes executados nos serviços tipo I não devem ser usados de forma isolada para a tomada de decisões clínicas. Esses testes devem ser usados como triagem, com vistas a oferecer um ponto de partida objetivo, em conjunto com a rotina de avaliação dos profissionais de saúde, para oferecer o suporte adequado aos pacientes. Portanto, o resultado de um teste rápido necessita da interpretação de profissionais de saúde, que devem associá-lo aos dados clínicos do indivíduo e à realização de outros exames laboratoriais confirmatórios", reforça a Anvisa.
Em nota, a agência avalia que a nova norma representa um avanço importante em relação à ampliação da lista de serviços executados em farmácias e consultórios, a fim de permitir o melhor acesso da população à assistência à saúde, bem como garantir a qualidade dos exames de análises clínicas no país.
A Anvisa disse que ainda não há uma lista pré-definida de quais exames serão oferecidos.
De acordo com a Abrafarma, os serviços que podem ser executados são:
Beta-hCG
Dengue Antígeno NS1
Hemoglobina Glicada A1c
Check-up Pós-Covid Anticorpos Anti-Spike
Colesterol Total
Avaliação de Controle de Asma
Dengue Anticorpos IgG IgM
Glicemia
Glicemia e Pressão Arterial
Glicemia e Perfil Lipídico
Hormônio Luteinizante (LH)
Toxoplasmose
Teste de Intolerância Alimentar
Exames do coração check-up completo
VSR - Vírus Sincicial Respiratório
VSR Molecular - Vírus Sincicial Respiratório
Zika Vírus Anticorpos
Teste Rápido PSA
Teste Rápido Adenovírus
Teste Rápido HIV
Teste Rápido Covid-19 Anticorpos
Teste Rápido Covid-19 Antígeno
Teste Rápido Covid-19 Antígeno + Anticorpos
Teste Rápido Covid-19 Molecular
Teste Rápido Ácido Úrico
Teste Rápido Chikungunya
Teste Rápido Lactato
Teste Rápido Malária
Teste Rápido Sífilis
Teste Rápido Troponina Cardíaca
Teste Rápido Ferritina
Teste Rápido Mioglobina
Teste Rápido Streptococcus Grupo A Molecular
Teste Rápido Streptococcus Grupo A
Teste Rápido Hepatite C
Teste Rápido Vitamina D
Avaliação de Controle da Asma
Teste Rápido Proteína C Reativa
Teste Rápido Rubéola
Teste Rápido Dímero-D
Teste Rápido Dengue Antígeno e Anticorpos
Teste Rápido Febre Amarela
Teste Rápido Helicobacter Pylori
Teste Rápido Influenza Molecular
Teste Rápido de Alergia Alimentar
Teste Rápido Tipo Sanguíneo
Medição de Pressão arterial
A Agência Nacional de Vigilância Sanitária (Anvisa) revogou, nessa segunda-feira (11), a resolução que suspendia a fabricação, comercialização, distribuição e o uso de todos os alimentos em estoque fabricados pela Fugini Alimentos Ltda.
De acordo com a Anvisa, a revogação foi publicada após a empresa passar por nova inspeção sanitária conduzida pelo Centro de Vigilância Sanitária de São Paulo e pela vigilância sanitária municipal entre os dias 3 e 5 de abril.
“A equipe avaliou as reformas no estabelecimento e as adequações em seus procedimentos de modo a cumprir com as determinações da vigilância sanitária. O estabelecimento foi considerado apto para retomar a fabricação de seus produtos na unidade de Monte Alto, no estado de São Paulo.
Já o processo de fabricação que contêm ingredientes alergênicos, de acordo com a agência, ainda precisa ser adequado para impedir a contaminação entre produtos. Também é necessária avaliação complementar da documentação de controle de qualidade dos produtos em estoque para obter mais informações sobre a segurança e a qualidade.
Seguem mantidas, portanto, a suspensão da fabricação de produtos com ingredientes alergênicos e a distribuição, comercialização e o uso de itens acabados em estoque da empresa fabricados até o dia 27 de março de 2023, além de polpas de tomate utilizadas como matéria-prima, fabricadas ou adquiridas até essa data. As informações são da Agência Brasil.
Deputados da Frente Parlamentar da Agropecuária (FPA), a bancada ruralista, são contra a proposta para criar uma CPI dos Agrotóxicos, cujo objetivo seria investigar se a Anvisa e o Ibama atuaram para beneficiar determinadas empresas em decisões sobre agrotóxicos. As informações são do Metrópoles, parceiro do Bahia Notícias.
De acordo com a publicação, o pedido de CPI está sendo articulado por Paulo Bilynskyj, do PL de São Paulo, e conta com apoio da Associação Brasileira dos Produtores de Soja (Aprosoja), entre outros produtores rurais.
A tese defendida por eles é de que a Anvisa e o Ibama deram decisões que beneficiaram a Syngenta, gigante do setor. O requerimento cita também a Bayer, outra fornecedora de agrotóxicos com força no mercado brasileiro.
Para integrantes da FPA ouvidos pela coluna, a CPI só atrapalha a articulação pelo marco legal dos defensivos, projeto defendido pela bancada. Além disso, deputados defendem que uma comissão parlamentar de inquérito não é o melhor método para lidar com o problema.
A Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu a fabricação, a comercialização, a distribuição e o uso de todos os alimentos produzidos pela empresa Fugini Alimentos na sua fábrica localizada em Monte Alto, no interior do estado de São Paulo. A medida foi publicada na última segunda-feira (27), através de uma resolução.
De acordo com a agência federal, a suspensão da comercialização, da distribuição e do uso é válida apenas para os produtos em estoque na empresa. Os principais alimentos fabricados pela empresa são molhos de tomate, conservas vegetais e outros molhos, como maioneses e mostardas.
A medida é preventiva e foi adotada após a realização de uma inspeção sanitária conjunta realizada pela Anvisa, pelo Centro de Vigilância Sanitária de São Paulo e pela Vigilância Sanitária municipal de Monte Alto.
Na ação, foram identificadas falhas graves de boas práticas de fabricação relacionadas à higiene, controle de qualidade e segurança das matérias-primas, controle de pragas e rastreabilidade, entre outras. Essas falhas podem impactar a qualidade e a segurança do produto final.
A suspensão da fabricação ficará válida até que a empresa adeque o processo de fabricação de seus produtos às boas práticas de fabricação.
MAIONESE FABRICADA COM MATÉRIA-PRIMA VENCIDA
Uma medida adicional deverá ser publicada pela Anvisa nesta quinta-feira (30), a fim de proibir a comercialização, a distribuição e o uso, e determina o recolhimento de todas as apresentações da maionese da marca Fugini, com vencimento em janeiro, fevereiro ou março de 2024.
A proibição vale também para todos os lotes que irão vencer em dezembro de 2023, com numeração iniciada por 354. A medida foi adotada em razão do uso de matéria-prima vencida na fabricação da maionese.
Estabelecimentos comerciais e consumidores que tiverem os lotes da maionese citados na resolução não devem utilizá-los e devem entrar em contato imediato com a empresa Fugini Alimentos Ltda., que deverá realizar seu recolhimento.
A Anvisa (Agência Nacional de Vigilância Sanitária) suspendeu a venda, a distribuição, a propaganda e o uso de lotes de preservativos masculinos das marcas Blowtex Zero e Blowtex Sensitive Super Aloe Vera. De acordo com o órgão, os produtos apresentaram falhas nos testes de estouro antes do prazo de validade.
Conforme publicou o jornal O Globo, a decisão foi publicada no Diário Oficial da União desta quinta-feira (23). A agência alega que a medida preventiva foi tomada "considerando que os lotes dos produtos falharam nos ensaios de estouro, após três anos, o que impossibilita a manutenção de sua validade por até cinco anos", ou seja, não passaram nos testes antes do período máximo de duração do produto que consta na embalagem. Segundo a Anvisa, a Blowtex deu início a "ações de campo de recolhimento" dos itens.
Em nota disponível em seu site, a Blowtex já avisava sobre os problemas com a validade. "Esteja ciente de que alguns lotes de nossos preservativos Blowtex Zero e Blowtex Sensitive Super Aloe Vera têm uma data de validade incorreta. Esses lotes foram inicialmente produzidos com prazo de validade de 5 anos a partir da data de fabricação. Testes laboratoriais recentes indicaram que pode haver um risco maior de ruptura para preservativos com mais de 3 anos de fabricação", diz o comunicado. Agora a Anvisa decidiu suspender os itens.
O chamado teste de estouro é um dos controles de qualidade para garantir que o produto está apto a cumprir com as suas finalidades, no caso do preservativo manter-se íntegro e evitar o contato da pele da região genital dos indivíduos envolvidos na relação sexual. O procedimento consiste em pressionar a camisinha com uma tensão máxima de ar até que ela se rompa. Se isso ocorrer antes dos valores estipulados, ela falha no teste por oferecer maior risco de rasgar durante o ato sexual.
Na nota, a Blowtex ressalta ainda que, em caso de ruptura, o indivíduo "deve tomar precauções adicionais para reduzir a chance de gravidez ou de infecções sexualmente transmissíveis". Neste caso, é possível receber a pílula do dia seguinte, para evitar uma gestação indesejada, e a Profilaxia Pós-Exposição (PEP) que previne a infecção pelo HIV.
A Agência Nacional de Vigilância Sanitária (Anvisa) vai analisar um pedido de Autorização de Uso Emergencial para a versão da vacina bivalente contra a Covid-19, desenvolvida pelo laboratório farmacêutico Moderna e comercializada pela Adium. O pedido foi apresentado nesta sexta-feira (17).
Segundo a Anvisa, a vacina bivalente contém uma mistura de cepas do vírus SARS-Cov-2 e promete conferir maior proteção à variante Ômicron, quando comparada com vacinas monovalentes. Por sua transmissibilidade, observa a agência, a variante Ômicron causa preocupação às autoridades sanitárias do país.
A Adium havia apresentado o pedido de registro da vacina, em janeiro. "Este pedido se encontra em análise pela equipe técnica da Anvisa. Porém, a empresa decidiu protocolar a Autorização de Uso Emergencial, paralelamente ao pedido do registro, de acordo com a manifestação favorável do Ministério da Saúde, conforme previsto no parágrafo único do Art. 1º da Resolução (RDC) 688, de 13 de maio de 2022", explicou à agência, em nota.
Uma vez recebido o pedido de Autorização de Uso Emergencial, a Anvisa tem 30 dias para concluir sua avaliação. Esse prazo é interrompido sempre que for necessário solicitar à empresa a complementação de informações ou esclarecimentos sobre os dados de qualidade, de eficácia e de segurança apresentados.
Curtas do Poder
Pérolas do Dia
Luciano Simões
"Estou sabendo é dos partidos que estão firmes".
Disse o presidente do União Brasil em Salvador, deputado estadual Luciano Simões sobre o apoio de partidos a candidatura de Bruno Reis.